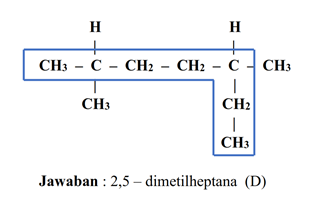
- Perhatikan rumus struktur berikut!
Menurut kaidah IUPAC, nama senyawa dari rumus struktur diatas adalah...
a. 2 – etil – 4 – metilheksana
b. 5 – metil – 3 – metilheksana
c. 3 – metil – 5 – metilheptana
d. 2,5 – dimetilheptana
e. 3,5 – dimetilheptana
Pembahasan - Nama senyawa CH3 – C(CH3)2 – CH = CH2 adalah...
a. Heksena
b. Heksana
c. 2,2 – dimetilbutana
d. 3,3 – dimetil – 1 – butuna
e. 3,3 – dimetil – 1 – butena
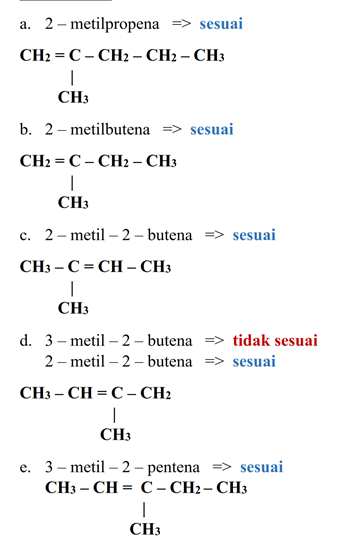
Pembahasan - Diantara nama berikut, yang tidak sesuai dengan aturan IUPAC adalah...
a. 2 – metilpropena
b. 2 – metilbutena
c. 2 – metil – 2 – butena
d. 3 – metil – 2 – butena
e. 3 – metil – 2 – pentena
Pembahasan - Reaksi antara etena dengan asam klorida yang menghasilkan etilklorida tergolong reaksi...
a. Adisi
b. Subtitusi
c. Polimerisasi
d. Dehidrasi
e. Eliminasi
Pembahasan - Yang merupakan isomer struktur dari 2,3 – dimetil – 1 – butena adalah...
a. 2 – butena
b. 2 – heksena
c. 2 – metil – 1 – butena
d. 2,2 – dimetil – 1 – pentena
e. 2,2 – dimetil – 1 – butena
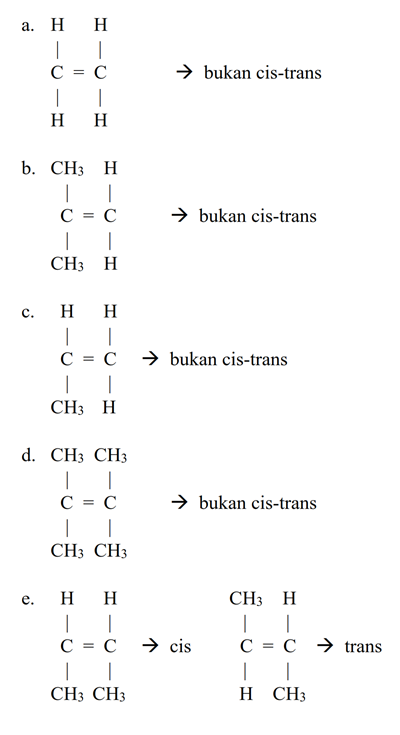
Pembahasan - Senyawa yang mempunyai isomer cis-trans adalah ....
a. CH2 = CH2
b. C(CH3)2 = CH2
c. CHCH3 = CH2
d. C(CH3)2 = C(CH3)2
e. CHCH3 =CHCH3
Pembahasan - Berikut ini yang merupakan isomer posisi dari 1 – heptuna adalah...
a. 3 – metil – 2 – heksuna
b. 4,4 – dimetil – 2 – pentuna
c. 2 – heptuna
d. 3,4 – dimetil – 1 – pentuna
e. 3,3 – dimetil – 1 – pentena
Pembahasan - Cara yang digunakan untuk memisahkan fraksi-fraksi minya bumi adalah...
a. Distilasi
b. Ekstraksi
c. Sublimasi
d. Dekantasi
e. Adisi
Pembahasan - Fraksi-fraksi minyak bumi berikut yang disusun berdasarkan urutan kenaikan titik didih adalah...
a. Bensin, nafta, LPG
b. Nafta, kerosin, solar
c. Kerosin, nafta, solar
d. Solar, kerosin, nafta
e. Solar, nafta, kerosin
Pembahasan - Yang merupakan penentu kualitas bensin adalah...
a. Isooktana
b. Isobutana
c. Heksana
d. Isopentana
e. Propana
Pembahasan - Jika bensin premium memiliki persentase 40% n-heptana dan 60% isooktana, bilangan oktan bensin tersebut adalah...
a. 20
b. 40
c. 60
d. 80
e. 100
Pembahasan - Pernyataan yang benar mengenai reaksi endoterm adalah...
a. Entalpi awal lebih besar daripada entalpi akhir, ΔH > 0
b. Entalpi awal lebih kecil daripada entalpi akhir, ΔH > 0
c. Entalpi awal lebih kecil daripada entalpi akhir, ΔH < 0
d. Entalpi awal lebih besar daripada entalpi akhir, ΔH < 0
e. Entalpi awal sama dengan entalpi akhir, ΔH = 0
Pembahasan - Persamaan reaksi yang menunjukkan perubahan entalpi pembentukan standar, kecuali...
a. 2H2 (g) + O2 (g) --> 2H2O (l); ΔH = +572 kJ
b. 4Na (s) + O2 (g) --> 2Na2O (s); ΔH = -418,4 kJ
c. N2 (g) + O2 (g) --> 2NO (g); ΔH = +181,6 kJ
d. C (s) + O2 (g) --> CO2 (g); ΔH = -393,3 kJ
e. CH4 (g) + 2O2 (g) --> CO2 (g) + 2H2O (l); ΔH = -888,7 kJ
Pembahasan - Pada pelarutan 40 gram kristal NaOH (Mr = 40) dalam 50 mL air, terjadi kenaikan suhu dari 27 °C menjadi 32 °C. Jika kalor jenis = 4,2 J/g°C, maka entalpi pelarutan NaOH, dinyatakan dalam kJ mol-1 adalah...
a. -1,89 kJ
b. -0,945 kJ
c. -0,47 kJ
d. +0,945 kJ
e. +1,89 kJ
Pembahasan - Kalor yang dihasilkan dalam pembakaran 15 gram gas etana (C2H6) (Ar C = 12 dan H = 1) berdasarkan reaksi dibawah ini:
2C2H6 (g) + 7O2 (g) à 4CO2 (g) + 6H2O (l) ΔH = -3084 kJ
a. -385,5 kJ
b. -1850,4 kJ
c. -771 kJ
d. -3084 kJ
e. -1542 kJ
Pembahasan - Diketahui:
2Fe + 3/2 O2 --> Fe2O3; ΔH = -840 kJ
2Al + 3/2 O2 --> Al2O3; ΔH = -1680 kJ
Nilai ΔH untuk reaksi:
2Al (s) + Fe2O3 (s) --> Al2O3 (s) + 2Fe (s) adalah...
a. -2520 kJ
b. +2520 kJ
c. -1680 kJ
d. +840 kJ
e. -840 kJ
Pembahasan - Diketahui:
ΔHf NH3 (g) = -92 kJ/mol
ΔHf HCl (g) = -184 kJ/mol
Reaksi: NH3 (g) + HCl (g) à NH4Cl (g) memiliki perubahan entalpi = -176 kJ. Kalor pembentukan NH4Cl (g) sebesar... kJ/mol.
a. -176
b. +276
c. -276
d. -452
e. +100
Pembahasan - Diketahui energi ikatan rata-rata:
C – H = 415 kJ/mol
C – C = 348 kJ/mol
C = C = 607 kJ/mol
C – Br = 276 kJ/mol
Br – Br = 193 kJ/mol
Besarnya perubahan entalpi pada reaksi:
H – C = C – H + Br – Br --> H – C – C – H
| |
Br Br
a. -50 kJ
b. +100 kJ
c. -100 kJ
d. +200 kJ
e. +50 kJ
Pembahasan - Larutan urea [CO(NH2)2] dibuat dengan jalan melarutkan 3 gram urea ke dalam air sampai volume 250 mL. Konsentrasi larutan urea yang dibuat adalah... (Mr urea = 60)
a. 0,1 M
b. 0,2 M
c. 0,3 M
d. 0,4 M
e. 0,5 M
Pembahasan - Reaksi P + Q --> R + S. Pernyataan yang tepat untuk reaksi berikut adalah...
a. vp = +
b. vQ = +
c. vp = -
d. vR = -
e. vS = -
Pembahasan - Pada reksi antara gas H2 dan O2 pada suhu 25 °C sangat lambat, tetapi saat ditambahkan bubuk Pt, reaksi menjadi lebih cepat. Hal ini menunjukkan bahwa reaksi dipengaruhi oleh...
a. Katalis
b. temperatur
c. luas permukaan
d. konsentrasi
e. permukaan
Pembahasan - Kenaikan suhu akan mempercepat laju reaksi. Hal ini disebabkan kenaikan suhu akan...
a. meningkatkan energi aktivasi reaksi zat
b. meningkatkan konsentrasi zat yang bereaksi
c. meningkatkan energi kinetik dari molekul reaktan
d. meningkatkan tekanan ruang reaksi
e. meningkatkan luas permukaan
Pembahasan - Reaksi dibawah ini yang laju reaksinya paling besar adalah...
a. 2 gram batang Zn dengan larutan HCl 0,1 M
b. 2 gram batang Zn dengan larutan HCl 0,3 M
c. 2 gram serbuk Zn dengan larutan HCl 0,1 M
d. 2 gram serbuk Zn dengan larutan HCl 0,2 M
e. 2 gram serbuk Zn dengan larutan HCl 0,3 M
Pembahasan - Suatu reaksi yang melibatkan zat X dan Y menghasilkan reaksi sebagai berikut.
2X (g) + 2Y (g) --> Z (g)
Diperoleh data bahwa reaksi tersebut merupakan pangkat 2 terhadap pereaksi X dan orde total reaksi adalah 3. Rumus persamaan laju reaksi yang benar bagi reaksi tersebut adalah...
a. v = k [X]2 [Y]
b. v = k [X]2 [Z]2
c. v = k [X] [Y] [Z]
d. v = k [Z]3
e. v = k [X] [Y]2
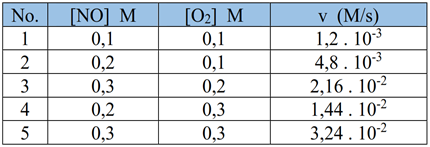
Pembahasan - reaksi A + B --> C
Berdasarkan percobaan diperoleh data berikut.
Persamaan laju reaksi dari reaksi diatas adalah...
a. v = k [A]2 [B]
b. v = k [A]2
c. v = k [A] [B]
d. v = k [B]
e. v = k [A] [B]2
Pembahasan - laju reaksi meningkat tiga kali lipat lebih cepat setiap kenaikan 10 °C. Jika laju reaksi pada suhu 25 °C adalah 4 M/detik, laju reaksi pada suhu 45 °C adalah...
a. 8 M/s
b. 12 M/s
c. 16 M/s
d. 24 M/s
e. 36 M/s
Pembahasan - Energi minimum yang dibutuhkan untuk berlangsungnya reaksi disebut...
a. Energi reaksi
b. Energi kimia
c. Energi kinetik
d. Energi aktivasi
e. Energi potensial
Pembahasan - Berikut ini adalah ciri-ciri terjadinya reaksi kesetimbangan, kecuali...
a. Reaksi reversible
b. Terjadi dalam ruang tertutup
c. Laju reaksi kekiri sama dengan laju reaksi ke kanan
d. Reaksinya tidak dapat balik
e. Tidak terjadi perubahan makroskopis
Pembahasan - Suatu reaksi dikatakan mencapai keadaan setimbang jika...
a. Jumlah mol pereaksi dan hasil reaksi sama
b. Masing-masing zat yang bereaksi telah habis
c. Reaksi sudah berhenti
d. Laju reaksi ke arah hasil reaksi sama dengan laju reaksi ke arah pereaksi
e. Reaksi berlangsung dengan laju reaksi pada dua arah berbeda
Pembahasan - Berikut ini faktor-faktor yang mempengaruhi pergeseran kesetimbangan, kecuali...
a. Konsentrasi
b. Tekanan
c. Katalisator
d. Volume
e. Suhu
Pembahasan - Diantara reaksi kesetimbangan di bawah ini yang mengalami pergeseran kesetimbangan ke kanan jika volume diperbesar adalah...
a. 3H2 (g) + N2 (g) --> 2NH3 (g)
b. 3NO (g) + O2 (g) --> 2NO2 (g)
c. PCl3 (g) + Cl2 (g) --> PCl5 (g)
d. 2HI (g) --> H2 (g) + I2 (g)
e. Fe3O4 (s) + 4H2 (g) --> 3Fe (g) + 4H2O (l)
Pembahasan - Pada reaksi N2 (g) + 3H2 (g) --> 2NH3 (g), jika pada suhu tetap konsentrasi N2 dikurangi, maka..
a. Kesetimbangan tak bergeser
b. Kesetimbangan bergeser ke kiri
c. Kesetimbangan bergeser ke kanan
d. Harga tetapan kesetimbangan makin besar
e. Pereaksi habis
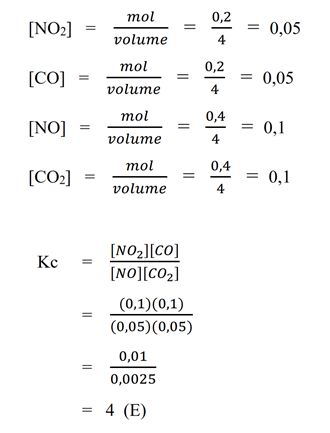
Pembahasan - Dalam ruang 4 liter terdapat reaksi kesetimbangan:
NO2 (g) + CO (g) à NO (g) + CO2 (g)
Jika pada saat setimbang terdapat gas NO2 dan gas CO masing-masing 0,2 mol, dan gas NO serta CO2 masing-masing 0,4 mol, maka besarnya tetapan kesetimbangan pada suhu tersebut adalah...
a. 0,25
b. 0,5
c. 1
d. 2
e. 4
Pembahasan - Dalam ruang 1 liter terdapat reaksi kesetimbangan:
2HI (g) --> H2 (g) + I2 (g)
Bila mula-mula terdapat 0,4 mol gas HI, dan diperoleh 0,1 mol gas hidrogen dan pada saat setimbang, maka besarnya derajat disosiasi HI adalah...
0,25
0,50
0,60
0,75
0,80
Pembahasan - Dalam ruang 1 liter dicampur 4 mol zat A dan 5 mol zat B. Reaksi kesetimbangan:
A (g) + 2B (g) --> C (g)
Jika pada saat setimbang diperoleh 2 mol C dan tekanan total 10 atm, maka besarnya Kp adalah...
a. 0,05
b. 0,25
c. 0,50
d. 0,60
e. 0,80
Pembahasan
- Tuliskan isomer posisi pentena!
Pembahasan - Sebutkan fraksi minyak bumi dari titik didih terendah!
Pembahasan - Diketahui energi ikatan:
H – H = 436 kJ/mol
Cl – Cl = 242 kJ/mol
H – Cl = 431 kJ/mol
Hitunglah entalpi pembentukan gas HCl berdasarkan reaksi:
H2 (g) + Cl2 (g) --> 2HCl (g)
Pembahasan - Diketahui data percobaan reaksi:
2NO + O2 --> 2NO2
a. Tentukan orde reaksi total!
b. Tentukan persamaan laju reaksi
c. Tentukan nilai k!
Pembahasan - Pada suhu 25 °C sebanyak 0,056 mol O2 dan 0,02 mol N2O ditempatkan dalam wadah 1 liter. Reaksi berlangsung sebagai berikut:
2N2O (g) + 3O2 (g) --> 4NO2 (g)
Ketika sistem mencapai kesetimbangan, konsentrasi NO2 adalah 0,02 mol/liter
a. Berapa konsentrasi N2O dan O2 pada keadaan setimbang?
b. Berapa nilai Kc untuk reaksi pada suhu 25 °C tersebut?
Pembahasan
Bila ada kesalahan dalam penulisan blog ini silahkan untuk meninggalkan komentar
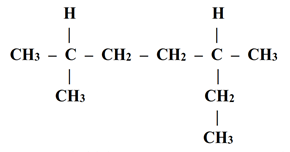










































Terimakasih untuk contoh soal² kimia nya kak ⛄
BalasHapusSama-sama semoga bermanfaat ya dek
HapusPermisi... itu nomor 31 kalau volume diperbesar, maka kesetimbangan bergeser ke koefisien lebih besar... pilihan C bergeser ke kanan karena koefisiennya lebih besar daripada di kiri... tapi kenapa itu bukan jawabannya ya??
BalasHapusMohon maaf sebelumnya, ada kesalahan pengetikan, option C itu reaksinya terbalik jadi jawabannya yang E
Hapuskak, boleh minta softfilenya nggak ya?
BalasHapusboleh minta soft file?
BalasHapus