METODE BILOKS (Bilangan Oksidasi)
Cara penyetaraan reaksi redoks dengan metode biloks :
Untuk reaksi tanpa muatan
1. Tentukan biloks masing-masing unsur
2. Tentukan unsur-unsur yang mengalami perubahan biloks, setarakan jika jumlah atom unsurnya berbeda
3. Tentukan perubahan biloks = Ʃ kenaikan / penurunan biloks × Ʃ atom
4. Samakan jumlah perubahan biloks dengan menambahkan koefisien yang sesuai.
5. Setarakan atom-atom lain dengan urutan Kation, Anion, Hidrogen, Oksigen (KAHO)
Untuk reaksi dengan muatan
1. Tentukan biloks masing-masing unsur
2. Tentukan unsur-unsur yang mengalami perubahan biloks, setarakan jika jumlah atom unsurnya berbeda
3. Tentukan perubahan biloks = Ʃ kenaikan / penurunan biloks × Ʃ atom
4. Samakan jumlah perubahan biloks dengan menambahkan koefisien yang sesuai
5. Setarakan jumlah muatan jika :
Suasana asam : tambahkan ion H+ diruas yang kekurangan muatan, setarakan dengan menambahkan H2O diruas yang lain
Suasana basa : tambahkan ion OH- diruas yang kelebihan muatan, setarakan dengan menambahkan H2O diruas yang lain
METODE SETENGAH REAKSI (Hanya berlaku pada reaksi yang memiliki suasana asam atau basa)
Cara penyetaraan reaksi redoks dengan metode setengah reaksi :
1. Tentukan biloks masing-masing unsur
2. Tentukan unsur-unsur yang mengalami perubahan biloks
3. Pisahkan setengah reaksi oksidasi dan setengah reaksi reduksi
4. Setarakan unsur-unsur yang mengalami perubahan biloks
5. Jika asam : setarakan jumlah atom dengan menambahkan H2O pada ruas yang kekurangan atom O
Jika basa : setarakan jumlah atom dengan menambahkan H2O pada ruas yang kelebihan atom O
6. Jika asam : setarakan jumlah atom H dengan menambah ion H+
Jika basa : setarakan jumlah atom H dengan menambah ion OH-
7. Setarakan jumlah muatan
8. Jumlahkan kedua reaksi
Setarakan reaksi dibawah ini dengan metode biloks
- MnO4- + C2O42- → Mn2+ + CO2 (Asam)
Pembahasan
- CuS + NO3- → Cu2+ + S + NO (Asam)
Pembahasan
- Bi2O3 + ClO- → BiO3- + Cl- (Basa)
Pembahasan
- As2S5 + HNO3 → H3AsO4 + H2SO4 + NO2 + H2O
Pembahasan
- BiO3- + VO+ → Bi2O3 + VO3+ (Basa)
Pembahasan
- H2O2 + MnO4- → Mn2+ + O2 (Asam)
Pembahasan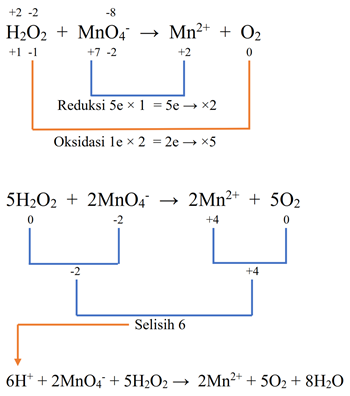
- Zn + NO3- → ZnO2- + NH3 (Basa)
Pembahasan
- ClO3 + KCl + H2SO4 → K2SO4 + Cl2 + H2O
Pembahasan
Setarakan reaksi dibawah ini dengan metode setengah reaksi
- MnO4- + C2O42- → Mn2+ + CO2 (Asam)
Pembahasan
- CuS + NO3- → Cu2+ + S + NO (Asam)
Pembahasan
- Bi2O3 + ClO- → BiO3- + Cl- (Basa)
Pembahasan
- BiO3- + VO+ → Bi2O3 + VO3+ (Basa)
Pembahasan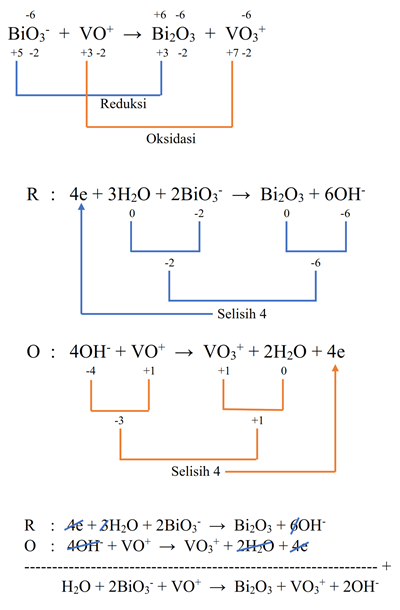
- H2O2 + MnO4- → Mn2+ + O2 (Asam)
Pembahasan
- Zn + NO3- → ZnO2- + NH3 (Basa)
Pembahasan
Note :
Bila terdapat kesalahan dalam penulisan blog ini silahkan untuk meninggalkan komentar





No1 soal beda dengan jawaban
BalasHapusMakasih min
BalasHapusHayo mau ngapain :v
BalasHapusKak untuk soal terakhir kenapa reduksinya 6H2O ya kak? Bukanya seharuse 3H2O?
BalasHapusMakasih min sangat bermanfaat :)
BalasHapusSangat bermanfaat
BalasHapusHayo mau ngapain :v
BalasHapusHayo mau ngapain :v
BalasHapusPembahasannya kok gak ada min
BalasHapus