Perhatikan gambar pengujian daya hantar beberapa larutan berikut!

Gambar yang merupakan larutan nonelektrolit dan elektrolit lemah berturut-turut adalah larutan nomor…
a. 1 dan 2
b. 2 dan 4
c. 3 dan 5
d. 4 dan 5
e. 5 dan 3
Pembahasan

Suatu zat padat dilarutkan dalam air, ternyata larutan zat itu dapat menghantarkan arus listrik. Pernyataan yang tepat untuk menerangkan peristiwa ini adalah....
a. Dalam air zat padat itu terurai menjadi ionnya.
b. Dalam air zat padat itu terurai menjadi atomnya.
c. Dalam air zat padat itu terurai menjadi molekulnya.
d. Air menjadi mudah terionisasi bila ada zat padat di dalamnya.
e. Air menjadi konduktor listrik bila ada zat terlarut di dalamnya.
Pembahasan

Diantara bahan berikut:
(1) Gula
(2) Garam
(3) Cuka
(4) Urea
(5) Pemutih
Yang dapat menghantarkan listrik adalah...
a. (1), (2), dan (3)
b. (1), (3), dan (5)
c. (2), (3), dan (5)
d. (1), (4), dan (5)
e. (2), (3), dan (4)
Pembahasan

Diketahui senyawa-senyawa berikut:
(1) HCl
(2) H2SO4
(3) NaCl
(4) MgCl2
(5) K2SO4
Dari kelompok senyawa tersebut yang termasuk senyawa kovalen yang dapat menghantarkan listrik adalah nomor...
a. (1) dan (2)
b. (1) dan (3)
c. (1) dan (4)
d. (2) dan (3)
e. (3) dan (4)
Pembahasan

Dari larutan berikut ini, yang diharapkan dapat menghantarkan arus listrik paling baik adalah...
a. Urea 1 M
b. Asam cuka 0,1 M
c. Asam cuka 1 M
d. Asam sulfat 1 M
e. Ammonium hiroksida 1 M
Pembahasan

Diketahui data hasil pengujian daya hantar listrik berbagai zat dalam 3 wujudnya sebagai berikut:

Elekrolit yang merupakan senyawa kovalen adalah...
a. P dan Q
b. Q dan S
c. Q dan R
d. Hanya S
e. R dan S
Pembahasan

Perhatikan pernyataan berikut!
(1) Penambahan muatan positif
(2) Pelepasan oksigen
(3) Kenaikan bilangan oksidasi
(4) Pengurangan muatan positif
(5) Pelepasan elektron
Pernyataan yang sesuai dengan konsep oksidasi adalah...
a. (1), (2), dan (4)
b. (1), (3), dan (4)
c. (2), (3), dan (4)
d. (1), (3), dan (5)
e. (2), (4), dan (5)
Pembahasan

Reaksi-reaksi berikut yang merupakan reaksi redoks adalah...
a. 2NaOH + H2SO4 → Na2SO4 + H2O
b. NaOH + HCl → NaCl + H2O
c. FeO + 2HCl → FeCl2 + H2O
d. CuO + H2 → Cu + H2O
e. CO2 + CaO → CaCO3
Pembahasan

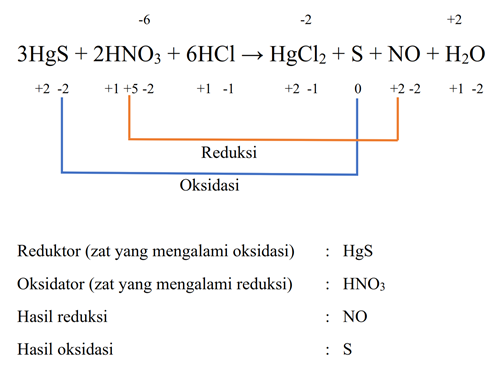
Zat yang merupakan oksidator dan hasil oksidasi pada reaksi berikut adalah...
3HgS + 2HNO3 + 6HCl → HgCl2 + S + NO + H2O
a. HgS dan S
b. HNO3 dan S
c. HNO3 dan NO
d. HNO3 dan HgCl2
e. HCl dan S
Pembahasan
Pada reaksi: H2SO4 + 8HI → H2S + 2I2 + 4H2O. Bilangan oksidasi belerang berubah dari...
a. -2 menjadi +2
b. -2 menjadi +6
c. +6 menjadi +2
d. +6 menjadi -2
e. +4 menjadi +6
Pembahasan

Nama yang tepat untuk senyawa MnS dan Fe2O3 adalah....
a. Mangan (I) sulfida dan besi (III) oksida
b. Mangan (II) sulfida dan besi (III) oksida
c. Mangan sulfida dan fero oksida
d. Magnesium sulfida dan feri oksida
e. Mangan (II) sulfida dan fero oksida
Pembahasan

Perhatikan tabel berikut!

Berdasarkan data tersebut hubungan yang benar ditunjukkan oleh nomor...
a. 1, 3, 4
b. 1, 4, 5
c. 2, 3, 4
d. 2, 4, 5
e. 3, 4, 5
Pembahasan

Jika logam aluminium direaksikan dengan larutan asam sulfat menghasilkan larutan aluminium sulfat dan gas hidrogen, maka penulisan persamaan reaksi yang benar adalah...
a. Al2(s) + 3H2SO4(aq) → Al2(SO4)3(aq) + 6H2(g)
b. 2Al(s) + H2SO4(aq) → AlSO4(aq) + H2(g)
c. Al2(s) + H2SO4(aq) → AlSO4(aq) + H2(g)
d. 3Al(s) + H2SO4(aq) → Al3(SO4)3(aq) + 2H2(g)
e. 2Al(s) + 3H2SO4(aq) → Al2(SO4)3(aq) + 3H2(g)
Pembahasan

Suatu reaksi samping pembuatan rayon dari pulp kayu adalah sebagai berikut:
a Cs2 + b NaOH → c Na2CS3 + d Na2CO3 + e H2O
Persamaan reaksi tersebut setara apabila nilai...
a. a = 2/3 c
b. b = 3d
c. c = 1/3 d
d. d = e
e. e = 1/2 b
Pembahasan

Sebanyak 24 gram batu pualam direaksikan dengan 36 gram asam klorida dalam wadah tertutup menurut persamaan reaksi: CaCO3(s) + 2HCl(aq) → CaCl2(aq) + H2O(l) + CO2(g). Massa senyawa hasil reaksi diperkirakan adalah...
a. Sama dengan 60 gram
b. Sama dengan 54 gram
c. Lebih besar dari 60 gram
d. Lebih kecil dari 60 gram
e. Lebih kecil dari 54 gram
Pembahasan

Sebanyak 3 gram logam magnesium dibakar dengan 2 gram oksigen dalam ruang tertutup menurut persamaan reaksi: 2Mg(s) + O2(g) → 2MgO(s). Massa magnesium oksida yang dihasilkan adalah... (massa molar Mg = 24, O = 16)
a. 3 gram
b. 4 gram
c. 5 gram
d. 6 gram
e. 8 gram
Pembahasan

Dari data persamaan reaksi: Fe + S → FeS didapat data sebagai berikut:

Berdasarkan data tersebut dapat disimpulkan bahwa perbandingan massa Fe dan S dalam FeS adalah...
a. 2 : 1
b. 3 : 2
c. 7 : 4
d. 10 : 7
e. 15 : 8
Pembahasan

Perbandingan massa kalsium dan massa oksigen membentuk kalsium oksida adalah 5 : 2. Jika 20 gram kalsium direaksikan dengan 10 gram oksigen, maka massa kalsium oksida yang terbentuk adalah...
a. 10 gram
b. 20 gram
c. 28 gram
d. 30 gram
e. 36 gram
Pembahasan

Unsur nitrogen dan oksigen dapat membentuk dua macam senyawa dengan data sebagai berikut:

Perbandingan masssa oksigen pada massa nitrogen yang sama (sesuai dengan hukum Dalton) adalah...
a. 1 : 2
b. 2 : 3
c. 3 : 4
d. 2 : 4
e. 3 : 5
Pembahasan

Unsur X dan Y membentuk 2 macam senyawa. Senyawa I mengandung 25% unsur X dan senyawa II mengandung 20% unsur X. Perbandingan massa unsur Y sesuai Hukum Kelipatan Perbandingan Dalton adalah...
a. 1 : 2
b. 2 : 3
c. 3 : 4
d. 4 : 3
e. 3 : 5
Pembahasan

Sebanyak 20 liter gas Nitrogen direaksikan dengan 50 liter gas oksigen menghasilkan 20 liter suatu gas nitrogen oksida (NxOy). Jika semua gas diukur pada tekanan dan temperatur yang sama, maka rumus molekul gas oksida nitrogen tersebut adalah...
a. NO
b. NO2
c. N2O4
d. N2O5
e. N5O2
Pembahasan

Lima liter gas hidrogen mengandung 3,01 × 1022 molekul H2. Pada suhu dan tekanan yang sama 20 liter gas CO2 mengandung molekul CO2 sebanyak...
a. 6 × 1022
b. 8 × 1023
c. 6 × 1023
d. 1,2 × 1023
e. 1,2 × 1024
Pembahasan

Jika diukur pada P dan T yang sama, untuk menghasilkan 100 liter uap air, maka diperlukan oksigen untuk membakar 100 liter gas hidrogen. Jika udara mengandung 20% gas oksigen, maka volume udara yang diperlukan sebanyak....
a. 50 liter
b. 100 liter
c. 250 liter
d. 500 liter
e. 1000 liter
Pembahasan

Campuran gas metana (CH4) dan propana (C3H8) yang volumenya 12 liter dibakar secara sempurna dengan gas O2. Jika diukur pada suhu dan tekanan yang sama, ternyata dihasilkan volume gas CO2 sebanyak 30 liter, maka kadar gas metana (CH4) dalam campuran gas tersebut adalah...
a. 10%
b. 25%
c. 30%
d. 50%
e. 75%
Pembahasan

Massa rata-rata 1 atom unsur X adalah a gram, sedangkan massa 1 atom C-12 adalah b gram, maka massa molar dari unsur X adalah...
a. 12a/b
b. 12b/a
c. 1/12 ab
d. 12 ab
e. ab
Pembahasan

Di alam ditemukan 2 isotop boron yaitu 10B dan 11B. Jika massa molar rata-rata B = 10,81, maka prosentasi keberadaan isotop 10B dan 11B adalah...
a. 10% dan 90%
b. 19% dan 81%
c. 20% dan 80%
d. 80% dan 20%
e. 81% dan 19%
Pembahasan

Diketahui massa molar atom Cu = 63,5; S = 32, O = 16; H = 1, maka massa molar dari molekul CuSO4.10H2O adalah...
a. 159,5
b. 179
c. 195,5
d. 239,5
e. 339,5
Pembahasan

Sebanyak x gram gas N2O (massa molar N = 14, O = 16) di masukkan ke dalam suatu tabung tertutup. Jika jumlah partikel gas tersebut = 3,01 × 1022 molekul, maka massa gas N2O adalah...
a. 1,1 gram
b. 2,2 gram
c. 3,3 gram
d. 4,4 gram
e. 5,5 gram
Pembahasan

Dua buah tabung mempunyai volume yang sama. Tabung I berisi 6 gram gas A dan tabung II mengandung 6,02 × 1022 molekul gas B. Jika temperatur dan tekanan kedua tabung sama, maka massa molar gas A adalah...
a. 90
b. 75
c. 60
d. 30
e. 25
Pembahasan

Pada suhu 0°C dan tekanan 1 atm (STP) 4,48 L gas N2 jika ditimbang mempunyai massa... gram. (massa molar N = 14)
a. 2,8
b. 5,6
c. 11,2
d. 28
e. 56
Pembahasan

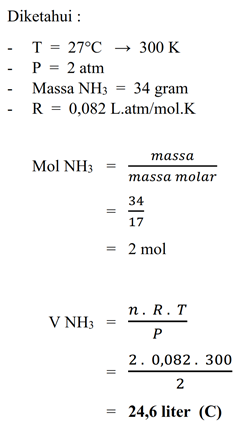
Pada 27°C dan 2 atm suatu gas NH3 (massa molar N = 14 dan H = 1) yang massanya 34 gram mempunyai volume sebesar... L (R = 0,082 L atm mol-1 K-1)
a. 2,46
b. 4,92
c. 24,6
d. 49,2
e. 246
Pembahasan
Sebanyak 12 gram senyawa organik terdiri dari 4,8 gram massa karbon, 0,8 gram massa hidrogen, dan sisanya oksigen. Jika diketahui massa molar senyawa tersebut adalah 60, maka rumus empiris dan rumus molekul senyawa organik tersebut berturut-turut adalah...
a. C2H2O dan CH3COOH
b. CH2O2 dan CH3COOH
c. CH2O dan CH3COH
d. CH2O dan CH3COCH3
e. CH2O dan CH3COOH
Pembahasan

Dalam 90 gram pupuk urea (CO(NH2)2) terdapat 21 gram nitrogen. Kemurnian pupuk tersebut adalah...
a. 42%
b. 50%
c. 75%
d. 80%
e. 90%
Pembahasan

Mineral Hematit (Fe2O3) dengan kemurnian 75% ditambang dari sebuah pegunungan. Jika mineral hematit tersebut sebanyak 2 ton, maka massa besi yang terkadung adalah ... ton
a. 0,525
b. 0,7
c. 1,05
d. 1,4
e. 2,8
Pembahasan

Sebanyak x gram FeS (massa molar = 88) direaksikan dengan asam klorida menurut reaksi: FeS(s) + 2HCl(aq) → FeCl2(aq) + H2S(g). Pada akhir reaksi diperoleh 8 liter gas H2S. Jika pada keadaan tersebut 1 mol gas H2O bervolume 20 L, maka nilai x adalah...
a. 8,8 gram
b. 17,6 gram
c. 26,4 gram
d. 35,2 gram
e. 44,0 gram
Pembahasan

Logam Aluminium yang bermassa 5,4 gram direaksikan dengan asam sulfat encer, menurut reaksi: 2Al(s) + 3H2SO4(aq) → Al2(SO4)3(aq) + 3H2(g). Volume gas hidrogen yang dihasilkan pada keadaan standar adalah... (massa molar Al = 27, O = 16, H = 1, S = 32)
a. 2,24 L
b. 4,48 L
c. 6,72 L
d. 13,44 L
e. 22,4 L
Pembahasan

Jika 24 gram logam magnesium direaksikan dengan 20 g oksigen menurut persamaan reaksi setara: 2 Mg(s) + O2(g) → 2MgO(s). Maka pernyataan berikut yang paling tepat berikut adalah... (massa molar Mg = 24, O = 16)
a. Terbentuk MgO sebanyak 44 gram
b. Massa oksigen yang bereaksi sebanyak 12 gram
c. Massa oksigen yang bersisa sebanyak 8 gram
d. Magnesium tepat habis bereaksi
e. Massa magnesium yang tersisa 4 gram
Pembahasan

Bila 0,4 mol larutan timbal (II) nitrat direaksikan dengan 0,4 mol larutan asam klorida dengan reaksi yang setara sbb: Pb(NO3)2(aq) + 2HCl(aq) → PbCl2(s) + 2HNO3(aq). Massa endapan PbCl2 (massa molar = 278) yang terbentuk dan pereaksi yang bersisa adalah...
a. 27,8 gram dan HCl
b. 27,8 gram dan Pb(NO3)2
c. 55,6 gram dan HCl
d. 55,6 gram dan Pb(NO3)2
e. 278 gram dan Pb(NO3)2
Pembahasan

Rumus kimia garam Barium Klorida berhidrat (BaCl2.xH2O) bila 5,96 gram garam tersebut, dipanaskan menghasilkan zat yang tersisa sebanyak 4,16 gram (massa molar Ba = 137, Cl = 35,5 H = 1, O = 16) adalah...
a. BaCl2.H2O
b. BaCl2.2H2O
c. BaCl2.3H2O
d. BaCl2.4H2O
e. BaCl2.5H2O
Pembahasan

Kadar air kristal dalam suatu hidrat dari Na2CO3 adalah 26%. Maka rumus hidratnya adalah... (massa molar Na = 23, C = 12, O = 16, H = 1)
a. Na2CO3.H2O
b. Na2CO3.2H2O
c. Na2CO3.3H2O
d. Na2CO3.4H2O
e. Na2CO3.5H2O
Pembahasan




































































