- Suatu larutan manitol yang mengandung 18,04 gram manitol dalam 100 gram air pada suhu 20°C mempunyai tekanan uap 17,23 mmHg. Jika tekanan uap jenuh air pada suhu tersebut adalah 17,54 mmHg; hitunglah massa molekul relatif manitol.
Pembahasan
Diketahui :
– G = 18,04 gram
– p = 100 gram
– P = 17,23 mmHg
– P° = 17,54 mmHg
Ditanya :
– massa molekul relatif (Mr) = ?
Jawab : - Berapa mmHg tekanan uap larutan sukrosa 2 m pada suhu 20°C, jika diketahui tekanan uap air murni pada suhu tersebut adalah 17,40 mmHg dan Mr air 18?
Pembahasan
Diketahui :
– m = 2 m
– P° = 17,40 mmHg
– Mr air = 18
Ditanya :
– tekanan uap larutan (P) = ?
Jawab :
Jika massa dan volume air tidak diketahui maka massanya dianggap 1 kg dan volumenya dianggap 1 liter
- Sebanyak 25 gram ureum yang dilarutkan dalam 525 gram air, pada suhu 20°C mempunyai tekanan uap 17,29 mmHg. Jika pada suhu tersebut tekanan uap air murni adalah 17,54 mmHg; tentukan Mr ureum tersebut.
Pembahasan
Diketahui :
– G = 25 gram
– p = 525 gram
– P = 17,29 mmHg
– P° = 17,54 mmHg
Ditanya :
– massa molekul relatif (Mr) = ?
Jawab : - Hitung tekanan uap larutan glukosa 36% dalam air pada suhu 25°C, jika diketahui tekanan uap air murni pada suhu tersebut adalah 20 mmHg.
Pembahasan
Diketahui :
– Larutan glukosa 36% (36 gram glukosa, 64 gram air)
– P° = 20 mmHg
Ditanya :
– tekanan uap larutan (P) = ?
Jawab :
Mr Glukosa (C6H12O6) = 180 - Sebanyak 9 gram glukosa dilarutkan dalam 900 gram air. Jika diketahui tekanan uap jenuh pelarut murni pada suhu 20°C adalah 17,5 mmHg; tentukan penurunan tekanan uap larutan pada suhu tersebut.
Pembahasan
Diketahui :
– G = 9 gram
– p = 900 gram
– P° = 17,5 mmHg
Ditanya :
– penurunan tekanan uap (ΔP) = ?
Jawab : - Diketahui tekanan uap air pada suhu 30°C adalah 31,84 mmHg. Untuk mendapatkan larutan yang tekanan uap jenuhnya 27,86 mmHg pada suhu tersebut; berapa massa glikol (Mr = 62) yang harus dilarutkan dalam 630 gram air?
Pembahasan
Diketahui :
– P° = 31,84 mmHg
– P = 27,86 mmHg
– p = 630 gram
– Mr = 62
Ditanya :
– massa glikol (G) = ?
Jawab :
- Hitunglah tekanan uap larutan jika 3 mol zat cair volatil (zat yang mudah menguap) dicampurkan dengan 4 mol zat cair nonvolatil. Diketahui tekanan uap jenuh zat cair volatil murni pada suhu tersebut adalah 50 mmHg.
Pembahasan
Diketahui :
– np = 3 mol
– nt = 4 mol
– P° = 50 mmHg
Ditanya :
– tekanan uap larutan (P) = ?
Jawab : - Hitunglah penurunan tekanan uap jenuh air, jika 45 gram glukosa (Mr = 180) dilarutkan dalam 90 gram air. Diketahui tekanan uap jenuh air murni pada 20°C adalah 18 mmHg.
Pembahasan
Diketahui :
– G = 45 gram
– Mr = 180
– p = 90 gram
– P° = 18 mmHg
Ditanya :
– penurunan tekanan uap (ΔP) = ?
Jawab : - Larutan yang terbuat dari 31 gram zat X dalam 171 gram air mempunyai tekanan uap 28,5 mmHg. Pada suhu yang sama, tekanan uap air sebesar 30 mmHg. Tentukan massa molekul relatif zat X tersebut.
Pembahasan
Diketahui :
– G = 31 gram
– p = 171 gram
– P = 28,5 mmHg
– P° = 30 mmHg
Ditanya :
– Masa molekul relatif (Mr) = ?
Jawab : - Larutan urea pada suhu tertentu mempunyai tekanan uap 26,39 mmHg. Jika pada suhu tersebut tekanan uap air murni 29 mmHg, hitunglah massa urea dalam setiap 100 gram air pada larutan tersebut.
Pembahasan
Diketahui :
– P = 26,39 mmHg
– P = 29 mmHg
– p = 100 gram
Ditanya :
– massa (G) = ?
Jawab :
Mr Urea CO(NH2)2 = 60
Note :
Bila terdapat kesalahan dalam penulisan blog ini silahkan untuk meninggalkan komentar.



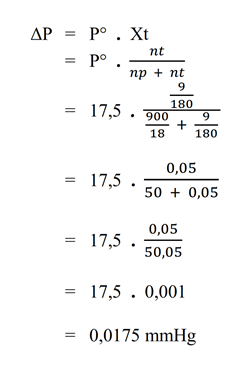
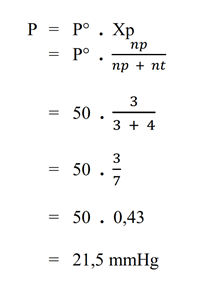
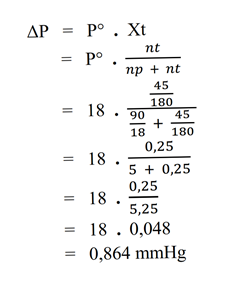

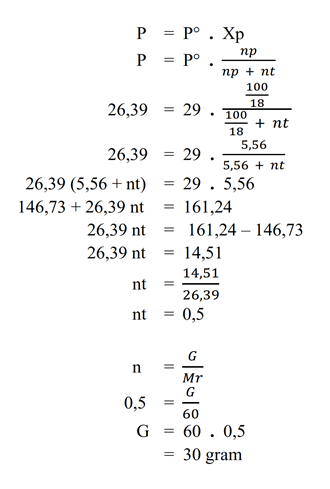





Molalitas pada no 2 itu 2 molal, tapi pada saat masuk persamaan malah menjadi 0,2 molal
BalasHapusSudah dibetulkan, mohon maaf karena ada kesalahan pengetikan. Terima kasih koreksinya.
HapusNilai nt pada no. 6 itu kok angkanya jadi 139,3 yah kak,?
BalasHapusSudah dibetulkan, mohon maaf ada kesalahan pengetikan. Terima kasih koreksinya 🙂
HapusNp dng nt itu apa ya?
BalasHapusmol pelarut dan mol terlarut
HapusHayo mau ngapain :v
BalasHapus