- Sebanyak 8 gram zat A dilarutkan dalam 200 gram air. Jika diketahui tetapan penurunan titik beku air (Kf) air = 1,86 °C/molal dan massa molar zat tersebut adalah 40 g/mol, hitung titik beku larutan.
Pembahasan
Diketahui :
- G = 8 gram
- p = 200 gram
- Kf = 1,86 °C/molal
- Mr = 40 g/mol
Ditanya :
- Titik beku larutan (Tf) = ?
Jawab : - Dalam 200 gram air terlarut 10 gram urea CO(NH2)2. Jika Mr urea 60 dan Kf air 1,86 °C/molal, hitung titik beku larutan urea tersebut.
Pembahasan
Diketahui :
- p = 200 gram
- G = 10 gram
- Mr = 60 g/mol
- Kf = 1,86 °C/molal
Ditanya :
- Titik beku larutan (Tf) = ?
Jawab : - Kedalam 250 mL air dilarutkan 6 gram urea CO(NH2)2. Jika tetapan penurunan titik beku air adalah 1,86 °C/molal, tentukan pada suhu berapa larutan tersebut mulai membeku pada tekanan 1 atm. (Ar C = 12, N = 14, O = 16, H = 1).
Pembahasan
Diketahui :
- p = 250 gram (massa jenis air 1 g/mL)
- G = 6 gram
- Kf = 1,86 °C/molal
Ditanya :
- Titik beku larutan (Tf) = ?
Jawab : - Larutan glukosa didalam air membeku pada suhu – 0,18 °C. Jika Kf air adalah 1,86 °C/molal, hitunglah berapa gram glukosa yang terlarut dalam setiap liter air. (Mr glukosa = 180).
Pembahasan
Diketahui :
- Tf = - 0,18 °C
- Kf = 1,86 °C/molal
- Mr = 180 g/mol
- V = 1 Liter
Ditanya :
- massa glukosa (G) = ?
Jawab : - Jika 6 gram urea dilarutkan ke dalam 100 gram air, akan terbentuk larutan yang titik bekunya – 1,86 °C. Berapa titik beku larutan yang terjadi jika 2,45 gram H3POs terlarut dalam 200 gram air? (Diketahui derajat ionisasi H3PO4 = 0,4; Ar p = 31, O = 16, H = 1 dan Mr Urea = 60).
PembahasanDiketahui :
- G1 = 6 gram
- p1 = 100 gram
- Tf1 = - 1,86 °C
- α H3PO4 = 0,4
- G2 = 2,45 gram
- p2 = 200 gram
Ditanya :
- Titik beku larutan H3PO4 (Tf2) = ?
Jawab : - Hitunglah tekanan uap, titik didih, dan titik beku larutan glukosa 36% dalam air pada suhu 25 °C, jika tekanan upa air murni pada suhu 25 °C adalah 20 mmHg. (Kb air = 0,52 °C/molal, Kf air 1,86 °C/molal, dan Mr glukosa = 180).
Pembahasan
Diketahui :
- larutan glukosa 36% (36 gram glukosa, 64 gram air)
- P° = 20 mmHg
- Kb = 0,52 °C/molal
- Kf = 1,86 °C/molal
- Mr = 180 g/mol
Ditanya :
- Tekanan uap larutan (P) = ?
- Titik didih larutan (Tb) = ?
- Titik beku larutaan (Tf) = ?
Jawab : - Sebanyak 3,84 gram zat A dilarutkan dalam 500 gram benzena. Larutan yang terbentuk dapat membeku pada suhu 0,3 °C di bawah titik beku benzena murni. Jika Kf benzena 4,5 °C/molal, hitunglah massa molekul relatif zat A.
Pembahasan
Diketahui :
- G = 3,84 gram
- p = 500 gram
- ΔTf = 0,3 °C
- Kf = 4,5 °C/molal
Ditanya :
- Mr = ?
Jawab : - Nikotin merupakan senyawa yang tersusun dari C, H, dan N. Pada pembakaran 4,38 mg nikotin dihasilkan 11,9 mg gas CO2 dan 3,41 mg air. Larutan dari 3,62 gram nikotin dengan 73,4 gram air membeku pada suhu – 0,563 °C. Jika Kf air 1,86 °C/molal dan Ar C = 12, H = 1, N = 14; tentukan rumus molekul dari nikotin tersebut.
Pembahasan
Diketahui :
- massa nikotin = 4,38 mg
- massa CO2 = 11,9 mg
- massa H2O = 3,41 mg
- Tf = - 0,563 °C
- Kf = 1,86 °C/molal
- G = 3,62 gram
- P = 73,4 gram
Ditanya :
- Rumus molekul dari nikotin = ?
Jawab: - Suatu zat bermassa 5,3 gram dilarutkan kedalam 500 gram air. Larutan yang terbentuk dapat membeku pada suhu – 0,576 °C. Tentukan Mr zat tersebut jika tetapan penurunan titik beku molal (Kf) air 1,86 °C/molal.
Pembahasan
Diketahui :
- G = 5,3 gram
- p = 500 gram
- Tf = - 0,576 °C
- Kf = 1,86 °C/molal
Ditanya :
- massa molekul relatif (Mr) = ?
Jawab : - Berapa liter glikol yang harus dicampurkan kedalam setiap liter air radiator agar air radiator tersebut tidak membeku pada suhu – 5 °C? Diketahui massa molar glikol 62 gram/mol; massa jenis glikol 1,1 g/mL; dan tetapan penurunan titik beku air 1,86 °C/molal.
Pembahasan
Diketahui :
- Mr = 62 g/mol
- Tf = - 5 °C
- Kf = 1,86 °C/molal
- ρ = 1,1 g/mL
Ditanya :
- massa molekul relatif (Mr) = ?
Jawab :
Sumber :
Buku Kimia untuk SMA/MA Kelas XII, Unggul Sudarmo, Penerbit Erlangga
Note :
Bila terdapat kesalahan dalam penulisan blog ini silahkan untuk meninggalkan komentar
Apabila punya pertanyaan silahkan DM di Instagram : @Chemistryisfun8
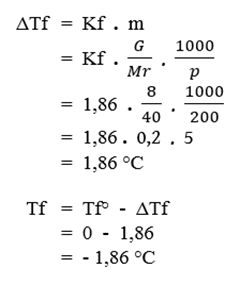













Maaf.. cth soal terakhir itu apakah pembahasannya Salah? Karna ditulis Tf nya sebagai -0.576°C sedangkan di soalnya Tf -5°C
BalasHapusOh iya, mohon maaf ada kesalahan pengetikan akan coba kita betulkan. Terima kasih sudah mengoreksi kesalahannya 🙂
HapusTerimakaaih atas soal dan pembahasannya , saya menjadi lebih paham belajar tentang penurunan titik beku larutan.
BalasHapusKenapa di soal terakhir hasil massanya 1667. Sedangkan saat dimasukan ke rumus massa jenis gramnya jadi 167. Bukannya harusnya hasil massanya adalah 166,7
BalasHapus