- Diketahui ΔHf H2CO3 (aq) = -699,65 kJ/mol. Hitunglah besarnya perubahan entalpi pada penguraian 496 gram H2CO3 (Ar H = 1, C = 12, O = 16) dan tuliskan persamaan termokimia penguraian H2CO3!
Pembahasan - Pada reaksi pembakaran bahan bakar bensin sesuai reaksi :
2C8H18 (g) + 25O2 (g) --> 16CO2 (g) + 18H2O (g) ; ΔH = -5.848,8 kJ/mol
Hitunglah besarnya kalor yang dibebaskan pada pembakaran 40 liter bensin (pada keadaan standar)!
Pembahasan - Diketahui :
a). N2 (g) + 3O2 (g) + H2 (g) --> 2HNO3 (aq) ; ΔH = -207 kJ/mol
b). N2O5 (g) + H2O (g) --> 2HNO3 (g) ; ΔH = +218 kJ/mol
c). 2H2 (g) + O2 (g) --> 2H2O (g) ; ΔH = -286 kJ/mol
Hitunglah ΔH untuk reaksi berikut :
2N2 (g) + 5O2 (g) --> 2N2O5 (g)
Pembahasan - Diketahui :
ΔHf H2O (g) = - 242 kJ mol-1
ΔHf HCl (g) = - 92 kJ mol-1
Hitunglah ΔH untuk reaksi berikut : 2Cl2 (g) + 2H2O –> 4HCl + O2
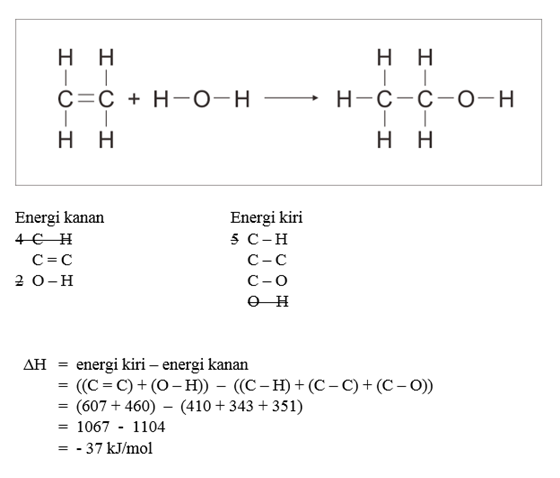
Pembahasan - Diketahui energi ikatan rata-rata :
C = C : 607 kJ/mol
C – C : 343 kJ/mol
C – H : 410 kJ/mol
O – H : 460 kJ/mol
C – O : 351 kJ/mol
Tentukan perubahan entalpi pada reaksi :
CH2 = CH2 (g) + H2O (g) --> CH3 – CH2 – OH (g)
Pembahasan
Note :
Bila ada kesalahan dalam penulisan blog ini silahkan untuk meninggalkan komentar
Bila punya pertanyaan silahkan DM : @Chemistryisfun8



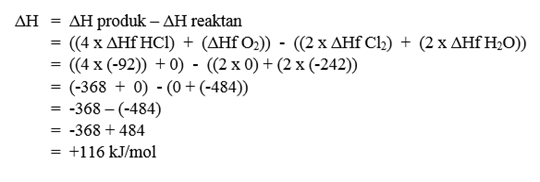





0 Comments:
Posting Komentar