- Diketahui suatu larutan basa lemah MOH mempunyai konsentrasi 0,001 M, Kb = 1.10-5 . Tentukan harga pH larutan tersebut!
PEMBAHASAN - Diberikan 5 reaksi asam basa menurut Bronsted-Lowry sebagai berikut.
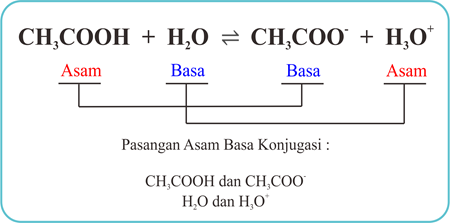
a. CH3COOH + H2O ⇌ CH3COO- + H3O+
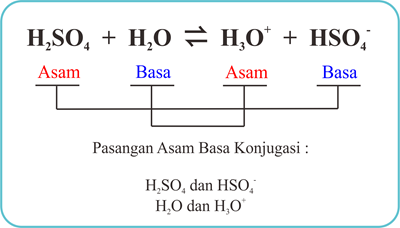
b. H2SO4 + H2O ⇌ H3O+ + HSO4-
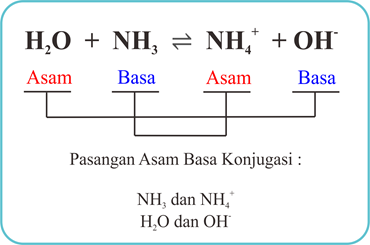
c. H2O + NH3 ⇌ NH4+ + OH-
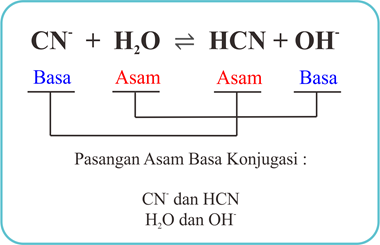
d. CN- + H2O ⇌ HCN + OH-
e. HSO4- + H2O ⇌ H3O+ + SO42-
Tunjukkan pasangan asam dan basa konjugasinya!
PEMBAHASAN
a. CH3COOH + H2O ⇌ CH3COO- + H3O+
b. H2SO4 + H2O ⇌ H3O+ + HSO4-
c. H2O + NH3 ⇌ NH4+ + OH-
d. CN- + H2O ⇌ HCN + OH-
e. HSO4- + H2O ⇌ H3O+ + SO42- - Tentukan pH dari :
a. Larutan H2SO4 0,005 M!
b. Larutan asam cuka 0,2 M, jika derajat ionisasi 0,1!
PEMBAHASAN
- Suatu asam lemah HA terionisasi sebanyak 10%. Tentukan pH 10 mL larutan HA 0,1 M.
PEMBAHASAN - Sebanyak 10 mL larutan Ba(OH)2 mempunyai pH = 12
a. Tentukan molaritas larutan
b. Berapa gram Ba(OH)2 dalam larutan (Mr = 171)
PEMBAHASAN
Sumber :
Kimia 2 : Untuk SMA/MA Kelas XI, Ari Harnanto, Pusat Perbukuan Departemen Pendidikan Nasional
Panduan Pembelajaran Kimia : Untuk SMA & MA Kelas XI, Suwardi, Pusat Perbukuan Departemen Pendidikan Nasional
Aktif Belajar Kimia : untuk SMA dan MA Kelas XI, Erfan Priambodo, Pusat Perbukuan Departemen Pendidikan Nasional
Note :
Bila terdapat kesalahan dalam penulisan blog ini silahkan untuk meninggalkan komentar
Apabila punya pertanyaan silahkan DM di Instagram : @Chemistryisfun8
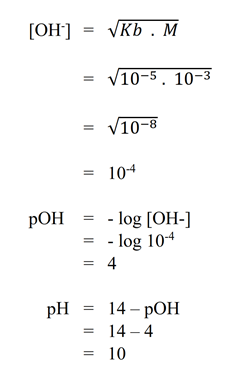

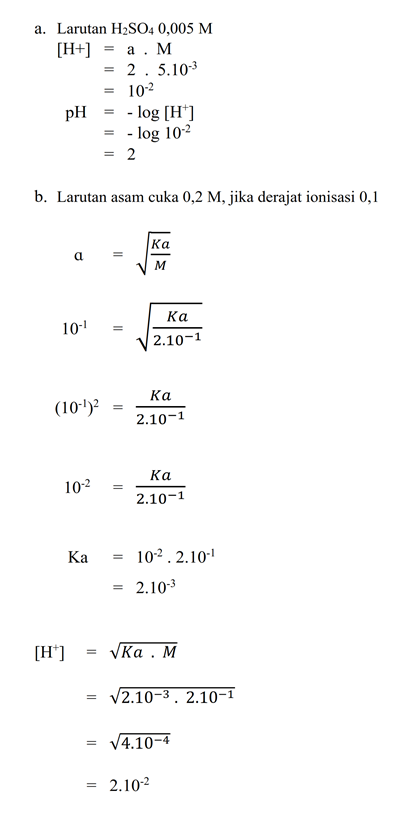
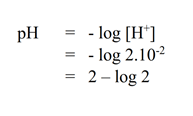
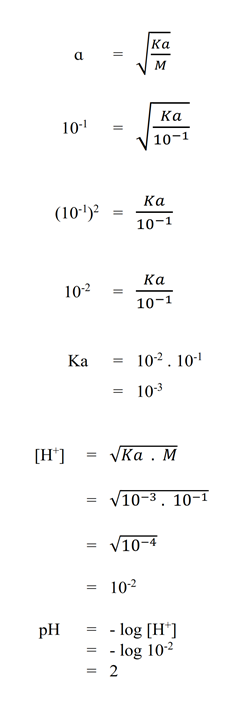






Soal pOH mana??
BalasHapusKak soal nomor 5a
BalasHapusBa(OH)2 dan Ba2+ itu molaritas nya didapat dari mana?
Dari perbandingan koefisien sama OH-, koefisien OH- itu kan 2 konsentrasinya 10^-2 sedangkan koefisien Ba(OH)2 sama Ba2+ itu cuma satu berarti konsentrasi mereka setengahnya konsentrasi OH- yaitu 0,5 × 10^-2 atau bisa juga 5 × 10^-3
Hapus