- Tentukan titik beku larutan 34,2 gram Al2(SO4)3 dalam 1000 gram air jika Kf air = 1,86 °C/molal (diketahui Ar Al = 27; S = 32; O = 16 dan dianggap zat yang terlarut terionisasi sempurna.
Pembahasan
Diketahui :
- G = 34,2 gram
- p = 1000 gram
- Kf = 1,86 °C/molal
- Zat terionisasi sempurna (elektrolit kuat)
Ditanya :
- Titik beku larutan (Tf) = ?
Jawab : - Sebanyak 1,2 gram MgSO4 dilarutkan kedalam air hingga volumenya 500 mL. Hitunglah tekanan osmotik dari larutan yang terjadi jika diketahui Ar Mg = 24, S = 32, O = 16.
Pembahasan
Diketahui :
- G = 1,2 gram
- V = 500 mL
Ditanya :
- Tekanan osmosi larutan (π) = ?
Jawab : - Berapa gram Na2SO4 yang harus dilarutkan kedalam 5 liter air agar air tersebut mendidih pada suhu 105,2 °C dan tekanan 1 atm? Diketahui Kb air = 0,52 °C/molal; Ar Na = 23, S = 32, O = 16.
Pembahasan
Diketahui :
- p = 5 kg (massa jenis air 5 Kg/L)
- Tb = 105,2 °C
- Kb = 0,52 °C/molal
Ditanya :
massa Na2SO4 (G) = ?
Jawab : - Larutan H3PO4 1 M isotonis (mempunyai tekanan osmosis sama) dengan larutan urea 2 M pada suhu yang sama hitunglah berapa persen larutan H3PO4 yang terionisasi dalam larutan.
Pembahasan
Diketahui :
- M H3PO4 = 1 M
- M urea = 2 M
- Kedua larutan isotonis
Ditanya :
- ɑ H3PO4 = ?
Jawab : - Jika larutan urea mendidih pada suhu 112 °C dan tekanan 1 atm, pada suhu berapakah larutan NaCl dengan konsentrasi yang sama akan mendidih?
Pembahasan
Diketahui :
- Tb urea = 112 °C
Ditanya :
- Tb NaCl = ?
Jawab : - Larutan CH3COOH 0,1 m membeku pada suhu yang sama dengan larutan glukosa 0,19 m. Hitunglah derajat ionisasi asam cuka dalam larutan tersebut.
Pembahasan
Diketahui :
- m CH3COOH = 0,1 m
- m glukosa = 0,19 m
Ditanya :
- ɑ CH3COOH = ?
Jawab : - Jika H2SO4 1 m membeku pada suhu – 5,4 °C dan diketahui Kf air = 1,8 °C/molal, hitunglah nilai derajat ionisasinya.
Pembahasan
Diketahui :
- m H2SO4 = 1 m
- Tf H2SO4 = - 5,4 °C
- Kf = 1,8 °C
Ditanya :
- ɑ H2SO4 = ?
Jawab : - Diketahui titik didih larutan urea 0,2 molal adalah 100,104 °C. Jika CaCl2 terionisasi sempurna, hitunglah titik didih larutan CaCl2 0,2 m.
Pembahasan
Diketahui :
- m urea = 0,2 m
- Tb urea = 100,104 °C
- m CaCl2 = 0,2 m
- CaCl2 terionisasi sempurna (elektrolit kuat)
Ditanya : - Hitunglah berapa titik beku larutan H2SO4 1 molal yang terionisasi 90%. (Kf air = 1,86 °C/molal).
Pembahasan
Diketahui :
- m H2SO4 = 1 m
- ɑ H2SO4 = 90% atau 0,9
- Kf = 1,86 °C/molal
Ditanya :
- Titik beku larutan (Tf) = ?
Jawab : - Tekanan osmosis larutan NaCl 0,1 M pada suhu 27 °C adalah 4,8 atm. Hitunglah derajat ionisasi larutan tersebut.
Pembahasan
Diketahui :
- M NaCl = 0,1 M
- T = 27 °C à 300 K
- π = 4,8 atm
Ditanya :
- derajat ionisasi NaCl (ɑ) = ?
Jawab :
Sumber :
Buku Kimia untuk SMA/MA Kelas XII, Unggul Sudarmo, Penerbit Erlangga
Note :
Bila terdapat kesalahan dalam penulisan blog ini silahkan untuk meninggalkan komentar
Apabila punya pertanyaan silahkan DM di Instagram : @Chemistryisfun8








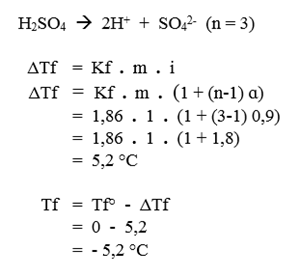
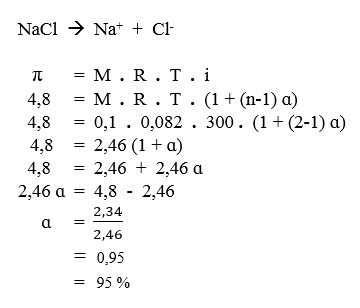





kak kenapa tidak bisa di copy?
BalasHapusKetika aku copy : " hayo mau ngapain :("
BalasHapusmau ngopi soalnya, malah jawabnya hayo mau ngpain, emang ngapa sih kok gak boleh?
BalasHapusPenurunan tekanan uapnya ga ada?
BalasHapusBuka pake browser Furefox terus tekan F9
BalasHapusfirefox
BalasHapus