- Urutkan kekuatan asam dari yang kuat ke yang lebih lemah (beri tanda >) untuk asam-asam yang diketahui Ka-nya berikut.
HA, Ka = 6,2.10-8
HB, Ka = 7,5.10-3
HC, Ka = 2,5.10-1
HD, Ka = 7,5.10-4
HE, Ka = 4,5.10-6
Pembahasan : - Hitunglah [H3O]+ dan pH larutan-larutan berikut:
-------------------------------------------------------------------------------------------------------------------------
H3O+ adalah H2O yang mengalami adisi atau penambahan H+, H2O sendiri tidak memiliki konsentrasi maka apabila kita menghitung konsentrasi H3O+ akan sama dengan menghitung konsentrasi H+
----------------------------------------------------------------------------------------------------------------------------------------------------------------
a. 0,049 M asam sianida (HCN) – Ka = 6,2.10-10
Pembahasan :
b. 0,5 M asam flourida (HF) – Ka = 6,6.10-4
Pembahasan :
c. 100 mL larutan mengandung 0,01 g CH3COOH – Ka = 1,8.10-5
Pembahasan :
d. 0,1 M asam nitrit (HNO2) – Ka = 7,2.10-4
Pembahasan :
- Berapa persen derajat ionisasi asam basa berikut:
a. 1,8 M asam format (Ka = 1,8.10-4)
Pembahasan :
b. 0,031 M asam hipoklorit (Ka = 2,9.10-8)
Pembahasan :
c. 3,8 M anilina (Kb = 4,0.10-10)
Pembahasan :
d. 0,18 M amonia (Kb = 1,8.10-5)
Pembahasan : - Berapa gram masing-masing zat terlarut yang terdapat dalam:
a. 100 mL larutan HCl yang pH-nya 2
Pembahasan :
b. 200 mL larutan NaOH yang pH-nya 13
Pembahasan :
c. 250 mL larutan CH3COOH yang pH-nya 5
Pembahasan :
d. 500 mL larutan NH4OH yang pH-nya 9 (Kb = 2,5.10-5)
Pembahasan : - Berapa pH larutan campuran berikut.
a. 250 mL HNO3 0,1 M + 250 mL air
Pembahasan :
b. 100 mL HCl 0,1 M + 150 mL HCl 0,2 M
Pembahasan :
c. 10 mL CH3COOH 0,1 M + 90 mL air (Ka = 1,8.10-5)
Pembahasan :
d. 100 mL NaOH 0,02 M + 400 mL air
Pembahasan :
Note:
Bila ada kesalahan dalam penulisan blog ini silahkan untuk meninggalkan komentar

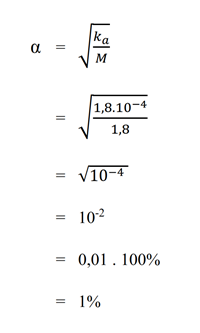
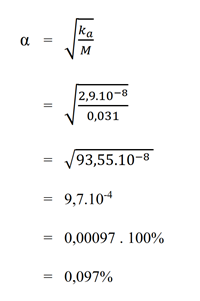
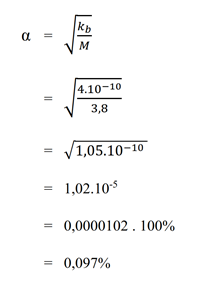
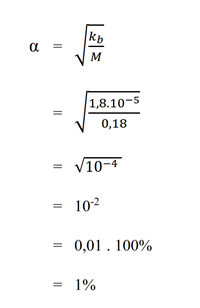

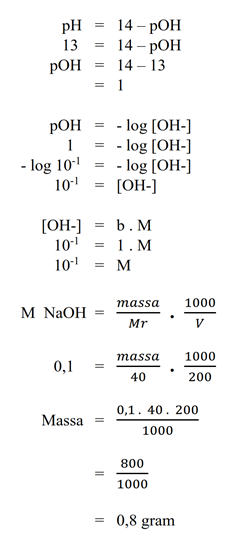











Terime kaseh banyakkkkkk😄🤠
BalasHapusMembantu sangat taw...
Pas gik besok UAS kimia
Thanks very much 💃💃💃
Sama-sama semoga bermanfaat
HapusTerima Kasih...
BalasHapusSangat Membantu😊
bagus sekali, pertahankan peformanya ;)
BalasHapus